En hipertermia oncológica, las principales tecnologías son la capacitiva y la radiativa. En este nuevo artículo de la serie de Hipertermia oncológica: ¿cuál es el camino hacia el tratamiento de calidad? examinamos sus características físicas. Buscamos comprender su impacto sobre los resultados clínicos de esta terapia. Así, continuamos el ejercicio de reflexión de cómo debería ser la hipertermia del presente y del futuro.
La hipertermia oncológica se utiliza de terapia adyuvante de la radioterapia y/o quimioterapia. Consiste en el calentamiento de los tumores entre los 39-45 °C durante una hora para mejorar la efectividad del tratamiento primario[1].
La serie surge a partir del webinar realizado en colaboración con la Sociedad Española de Física Médica (SEFM) el pasado 27 de febrero de 2025. En el primer artículo de esta serie en torno a los ingredientes necesarios para la calidad de la hipertermia oncológica tratamos de los mecanismos de acción. También de los aspectos físicos más relevantes (sobre todo la temperatura alcanzada en el tumor[2] y el intervalo de tiempo entre la hipertermia y la radioterapia[3]). Asimismo, introdujimos las tecnologías capacitiva y radiativa.
Los sistemas capacitivos fueron los primeros equipos de hipertermia oncológica y son los más fáciles de usar. Se basan en un campo eléctrico estático que se va alternando, generando un condensador. La alternancia entre la dirección del campo eléctrico es la que produce el calentamiento. Esto implica que no hay conformación porque no es posible la modulación.
Por el contrario, los sistemas radiativos, ya sean en forma de anillo dipolo (Pyrexar) o de cuatro antenas en fase o phased array (Med-Logix), utilizan ondas electromagnéticas en diferentes direcciones. Por tanto, se puede jugar con su intensidad y fase produciendo interferencias constructivas o destructivas en las zonas de interés. Esto permite desplazar el foco hacia las coordenadas del tumor y obtener el depósito de la potencia máxima en el objetivo, mientras se preservan el resto de tejidos. Se aprovecha que los mínimos y máximos interaccionan de forma distinta.
En la segunda entrega de la serie, a través de los estudios de simulación de Kok et al.[4]–[6], profundizamos en el impacto de las diferentes tecnologías en la calidad del tratamiento de hipertermia oncológica.
Sistemas capacitivos y radiativos de hipertermia oncológica para tumores profundos
Las diferencias tecnológicas entre los sistemas radiativos y capacitivos son patentes. Los avances de tecnología en hipertermia oncológica tienen un papel crucial en la comprensión de cómo trabaja el dispositivo y en la confianza que proporciona al usuario durante el tratamiento. Al fin y al cabo, estos factores influyen en el rendimiento de calentamiento del sistema en uso.
La planificación del tratamiento de hipertermia ha demostrado ser una herramienta muy útil para evaluar las características de calentamiento de diferentes sistemas de hipertermia[6]–[10].
Por eso, en [6], los autores optaron por emplear la planificación del tratamiento de hipertermia con Plan2Heat. Su objetivo era comprender la capacidad de calentamiento de los sistemas capacitivo y radiativo. Por ello, realizaron una simulación numérica 3D de SAR (Specific Absorption Rate) y de las distribuciones de temperatura.
La configuración elegida era sencilla: un fantoma y los dispositivos de hipertermia. El fantoma tenía diferentes tamaños (pequeño o grande), homogéneo o no homogéneo (con o sin capa de grasa) y con diferente ubicación del objetivo (céntrico o excéntrico). Los dispositivos de hipertermia simulados fueron un sistema capacitivo con dos electrodos y el sistema radiativo AMC-4[6]. Este último es un dispositivo desarrollado por el Amsterdam University Medical Center (AUMC), cuyo sucesor es ALBA 4D, fabricado por Med-Logix. El funcionamiento de AMC-4 y de ALBA 4D es idéntico[11].
En fantomas homogéneos, que simulan el tejido muscular, ambos sistemas de hipertermia logran un calentamiento del volumen objetivo. Sin embargo, en fantomas no homogéneos que simulan una capa superficial de tejido graso sobre el músculo (un modelo más realista) se aprecian diferencias significativas. Con el equipo capacitivo, la capa superficial absorbe mucha energía por las características dieléctricas de la grasa. De esta forma, en el fantoma pequeño se aprecia un calentamiento, pero ya no tan alto como en el fantoma homogéneo. Además, en el caso del fantoma grande no se produce ningún tipo de calentamiento. En cambio, con las antenas radiativas de la configuración de AMC-4, se supera la capa de grasa y se produce un calentamiento significativo incluso en los fantomas grandes[6].
Si bien en ambas tecnologías se generan puntos calientes, en la capacitiva estos son más limitantes: la absorción energética tan brusca en superficie podría hasta provocar quemaduras en los pacientes[6].
Los autores también trabajaron con simulaciones de pacientes a partir de bases de datos de TC de las localizaciones más frecuentes de tumores pélvicos tratados con hipertermia oncológica (cérvix, próstata, vejiga y recto). En cada región tumoral seleccionaron al paciente con la capa de grasa más fina y un paciente con una gran capa de grasa (>3 cm)[6].
En la mayoría de objetivos profundos, los sistemas capacitivos no muestran un calentamiento apropiado, con muy bajas temperaturas en el tumor. Por el contrario, la hipertermia radiativa, en general, resultó más efectiva en tumores pélvicos profundos. El estudio predijo temperaturas en el objetivo (T90) 1-3 °C más altas sin que se produjeran puntos calientes limitantes del tratamiento[6].
En 2020, Kok et al.[5] publicaron otro estudio de simulación con Plan2Heat. En esta ocasión, analizaron el calentamiento peritoneal en un fantoma y dos pacientes de cáncer pancreático. Modelaron un sistema capacitivo y varios radiativos, entre ellos, el sistema AMC-4 (el equivalente comercial a ALBA 4D, fabricado por Med-Logix). En el estudio se optimizaron y evaluaron las distribuciones de SAR.
La simulación del fantoma homogéneo, con estructura equivalente a músculo, mostró que la hipertermia capacitiva obtiene una distribución SAR en el objetivo homogénea. No obstante, los valores absolutos son bastante más bajos que la hipertermia radiativa. Esto se puede explicar porque la capa de PVC del fantoma tiene propiedades más o menos similares a la grasa. Los resultados del estudio concuerdan con los reportados en otras publicaciones[4], [6], [12].
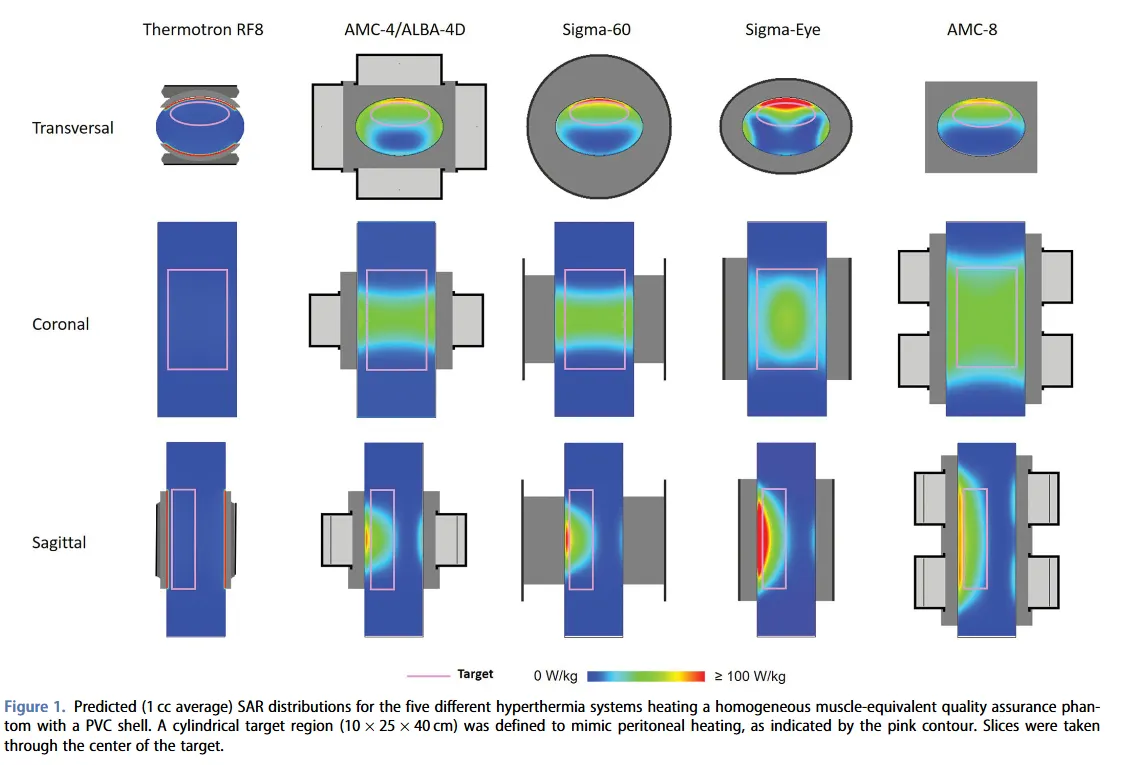
En el estudio también se simularon situaciones clínicas realistas a partir de TC de dos pacientes representativos de cáncer pancreático (uno con índice de masa corporal normal y otra con un porcentaje de grasa bajo). Los modelos de pacientes permitieron una comparación cualitativa entre los distintos dispositivos de hipertermia, al disponer de ocho tejidos/órganos en la región abdominal con contraste alto entre las propiedades dieléctricas y térmicas. La cobertura SAR se estudió en la región objetivo del tumor y en el peritoneo. Los resultados en los modelos de paciente validaron los obtenidos en el fantoma[5].
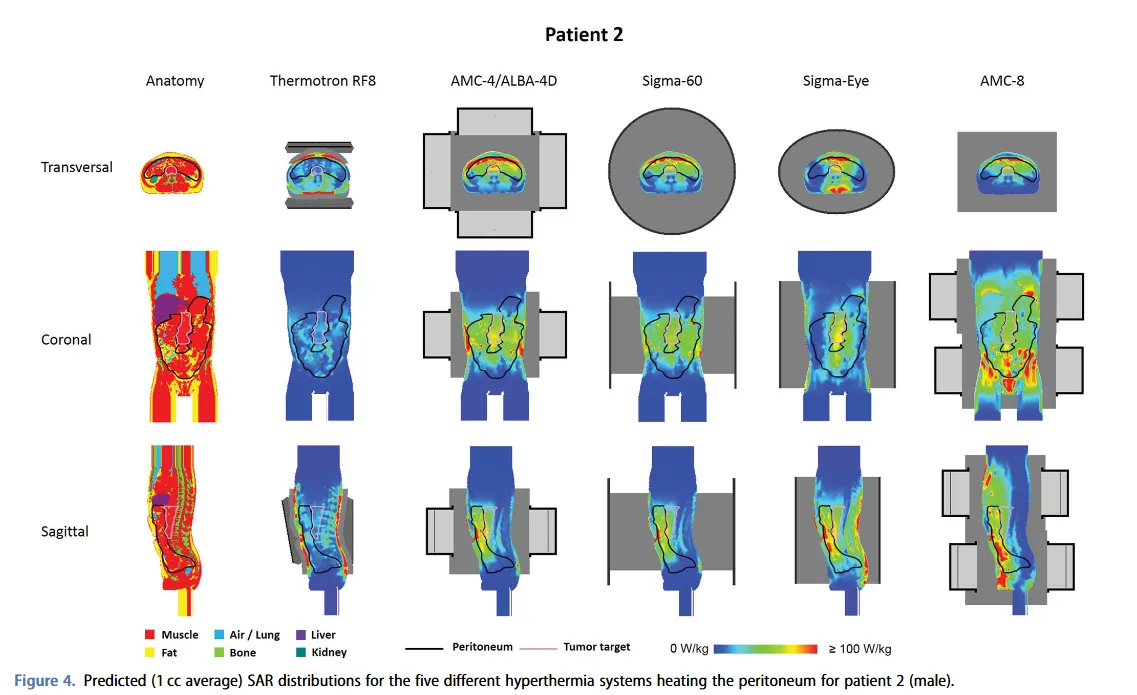
A continuación, resumimos el estudio de Kok and Crezee[4] sobre los sistemas capacitivos y radiativos de hipertermia superficial.
Hipertermia oncológica superficial con sistemas capacitivos y radiativos
A diferencia de la hipertermia profunda, la hipertermia superficial se aplica en tumores que se infiltran hasta 4 cm en el tejido.
El estudio de Kok and Crezee[4] pretendía dar respuesta a si hay diferencias de calentamiento entre los sistemas capacitivos y radiativos en hipertermia superficial. También si estas influían en los resultados clínicos de calidad. Para ello, utilizaron la planificación de hipertermia con un software propio. Este programa es el precursor de Plan2Heat y emplea cálculos de diferencias finitas de los vóxeles. Cuantificaron la calidad de calentamiento del objetivo en ambas técnicas con la cobertura de SAR y la temperatura (T10, T50 y T90)[4].
La lógica detrás del estudio fue similar a la empleada con la hipertermia profunda. Se modelaron dos electrodos de un sistema capacitivo. En vez de las antenas en fase del dispositivo radiativo de hipertermia profunda, se modeló un aplicador de microondas de contacto flexible CFMA como representante de los dispositivos radiativos superficiales. Se realizaron simulaciones de tres fantomas. El primero con una geometría equivalente a músculo. El segundo disponía de una capa de grasa uniforme de 1 cm sobre toda la superficie del fantoma. El tercero presentaba una geometría grasa-músculo comparable al segundo, aunque su capa de grasa solo recubría la mitad de la superficie[4].
De esta forma, el fantoma 1 permitió comparar las características básicas de calentamiento. Por otro lado, los fantomas 2 y 3 destacaban las diferencias en las propiedades de calentamiento cuando el tejido es heterogéneo[4].
Los autores modelaron además una paciente con una recurrencia de carcinoma de mama de la pared torácica. Este modelo se utilizó en el análisis de los aspectos anatómicos de la región objetivo. Así, se buscó comprender cuáles favorecen la hipertermia capacitiva y la hipertermia radiativa[4].
En la mayoría de los casos, el sistema radiativo CFMA consiguió una cobertura SAR mejor. En este sentido, la hipertermia radiativa parece más robusta en la obtención de temperaturas terapéuticas. Esto cobra especial relevancia en los fantomas 2 y 3, donde la región objetivo se sitúa más allá de la capa de grasa. Aquí, la tecnología capacitiva tiene una T90 de cerca de los 39 °C tanto con bolus salino como desionizado. Es decir, se encuentra por debajo de las temperaturas recomendadas en el tratamiento de hipertermia oncológica[4], [13].
A pesar de la optimización con bolus de la hipertermia capacitiva[4], [14]–[16], la publicación de Kok and Crezee[4] demuestra que los puntos calientes continúan siendo un problema clínico en anatomías heterogéneas. La tecnología radiativa evita las desventajas de la capacitiva, ya que la absorción de energía en el tejido graso de mala perfusión es mucho menor que en el muscular. Así, se producen temperaturas más altas en el objetivo, sin sobrecalentar el tejido heterogéneo sano[4].
Los estudios de simulación de Kok et al.[4]–[6] demuestran que solo se consiguen temperaturas terapéuticas con hipertermia capacitiva cuando se tratan pacientes con (casi) nada de grasa[6]. No obstante, no es el caso representativo del mundo occidental y países mediterráneos.
Las diferencias entre el calentamiento por dispositivos capacitivos y radiativos se deben a las características del campo eléctrico que producen y a las condiciones de interfase derivadas de las ecuaciones de Maxwell. Los electrodos capacitivos generan un campo eléctrico perpendicular a las interfases (superficiales) grasa-músculo. Por el contrario, el campo eléctrico de las antenas radiativas es paralelo a las interfases superficiales grasa-músculo.
Las ecuaciones de Maxwell determinan que el campo eléctrico tangencial (producido por la hipertermia radiativa) es continuo. En contraste, el componente normal del campo eléctrico (generado por los dispositivos capacitivos) sufre una discontinuidad proporcional a las propiedades dieléctricas de los dos tejidos. Por tanto, hay una alta absorción de energía en el tejido graso[5]. En consecuencia, no se alcanzan temperaturas terapéuticas en una parte sustancial del objetivo[4]. Además, esto ocurre tanto en tumores superficiales como profundos, si bien la diferencia es más marcada en los últimos.
Por el contrario, la hipertermia radiativa permite conformar la radiación electromagnética de manera que se induce el calentamiento en la región objetivo.
ALBA 4D y ALBA ON 4000D de Med-Logix
La propuesta del fabricante Med-Logix de hipertermia ALBA se fundamenta en la tecnología radiativa con un sistema de hipertermia superficial y semiprofunda y otro de hipertermia profunda. Así, da respuesta a las diferencias físicas de distinta profundidad de las lesiones.
ALBA 4D es el sistema de hipertermia profunda conformada. Consiste en cuatro antenas en fase que trabajan a 70 MHz, irradiando cuatro haces. Los haces se modulan de forma independiente y digital en fase y amplitud. Esto permite la colimación electrónica automática de los cuatro haces de radiofrecuencia en isofase. De esta forma, se enfoca la energía sobre el objetivo a cualquier profundidad y localización en pelvis, abdomen y extremidades.
El sistema de seguimiento ultrarrápido guiado por radiofrecuencia genera un foco de alta densidad en las coordenadas del objetivo. Se preservan así los tejidos sanos, incluidas las capas de grasa subcutánea[17]. De esta manera, se genera un aumento brusco de la temperatura efectiva de >41 °C (en menos de 5-10 minutos) y un intervalo de tiempo corto desde la desconexión del haz de radioterapia hasta que se logra la hipertermia de >41 °C.
ALBA ON 4000D es el sistema de hipertermia superficial y semiprofunda. La unidad funciona a una frecuencia fija de 434 MHz y está equipada con cuatro aplicadores de diferentes tamaños de antena microstrip (tecnología CCMA). La superficie con radio de curvatura fijo y la frecuencia de trabajo de 434 MHz permiten calentar con eficacia lesiones superficiales de hasta unos 4 ± 0,5 cm de profundidad, como se ha demostrado en fantomas[18], [19] y pacientes[20], [21]. Esta profundidad posibilita el tratamiento de lesiones superficiales y muchas lesiones semiprofundas.
ALBA ON 4000D alcanza la temperatura de 41 °C en menos de 6 minutos. Esto supone un aumento dos veces más rápido que el requisito mínimo de las directrices oficiales de la ESHO (European Society of Hyperthermic Oncology)[22]. Además, se caracteriza por la alta homogeneidad de distribución SAR que evita la aparición de puntos fríos/calientes.
Mediante estudios de simulación[4]–[6] se ha comprobado que la hipertermia capacitiva es incapaz de alcanzar las temperaturas de hipertermia en el objetivo salvo en pacientes con (casi) nada de grasa. Se debe a las características físicas de los dispositivos capacitivos y a las propiedades dieléctricas de la grasa. Solo los sistemas radiativos permiten la hipertermia oncológica en tumores superficiales y profundos.
En la siguiente entrega de esta serie profundizaremos en la física médica y su papel en la calidad del tratamiento de hipertermia. Si desea más información sobre la tecnología radiativa de hipertermia oncológica y los aspectos físicos detrás de su eficacia clínica, puede visualizar la grabación del webinar organizado en colaboración con la SEFM.
Le invitamos a suscribirse a nuestra newsletter bimestral para recibir las noticias de próximas publicaciones de la serie Hipertermia oncológica: ¿cuál es el camino hacia el tratamiento de calidad? También puede contactarnos en el siguiente enlace.
Referencias
[1] J. van der Zee, Z. Vujaskovic, M. Kondo, and T. Sugahara, ‘The Kadota Fund International Forum 2004-Clinical group consensus’, Int. J. Hyperthermia, vol. 24, no. 2, pp. 111–122, 2008.
[2] A. Bakker et al., ‘Post-operative re-irradiation with hyperthermia in locoregional breast cancer recurrence: Temperature matters’, Radiother. Oncol., vol. 167, pp. 149–157, 2022.
[3] C. M. van Leeuwen et al., ‘A short time interval between radiotherapy and hyperthermia reduces in-field recurrence and mortality in women with advanced cervical cancer’, Radiat. Oncol., vol. 12, no. 75, 2017.
[4] H. P. Kok and J. Crezee, ‘A comparison of the heating characteristics of capacitive and radiative superficial hyperthermia’, Int. J. Hyperthermia, vol. 33, no. 4, pp. 378–386, May 2017.
[5] H. P. Kok et al., ‘Locoregional peritoneal hyperthermia to enhance the effectiveness of chemotherapy in patients with peritoneal carcinomatosis: a simulation study comparing different locoregional heating systems’, Int. J. Hyperthermia, vol. 37, no. 1, pp. 76–88, 2020.
[6] H. P. Kok, F. Navarro, L. Strigari, M. Cavagnaro, and J. Crezee, ‘Locoregional hyperthermia of deep-seated tumours applied with capacitive and radiative systems: a simulation study’, Int. J. Hyperthermia, vol. 34, no. 6, pp. 714–730, Aug. 2018.
[7] K. D. Paulsen, S. Geimer, J. Tang, and W. E. Boyse, ‘Optimization of pelvic heating rate distributions with electromagnetic phased arrays’, Int. J. Hyperthermia, vol. 15, no. 3, pp. 157–186, May 1999.
[8] H. Kroeze, J. B. Van de Kamer, A. A. De Leeuw, and J. J. Lagendijk, ‘Regional hyperthermia applicator design using FDTD modelling’, Phys. Med. Biol., vol. 46, no. 7, pp. 1919–1935, Jul. 2001.
[9] P. Wust, M. Seebass, J. Nadobny, P. Deuflhard, G. Mönich, and R. Felix, ‘Simulation studies promote technological development of radiofrequency phased array hyperthermia’, Int. J. Hyperthermia, vol. 25, no. 7, pp. 517–528, 2009.
[10] M. De Greef, H. P. Kok, A. Bel, and J. Crezee, ‘3D versus 2D steering in patient anatomies: a comparison using hyperthermia treatment planning’, Int. J. Hyperthermia, vol. 27, no. 1, pp. 74–85, Jan. 2011.
[11] A. Bakker et al., ‘Comparison of the clinical performance of a hybrid Alba 4D and the AMC-4 locoregional hyperthermia systems’, Int. J. Hyperthermia, vol. 39, no. 1, pp. 1408–1414, 2022.
[12] M. Hiraoka, S. Jo, K. Akuta, Y. Nishimura, M. Takahashi, and M. Abe, ‘Radiofrequency capacitive hyperthermia for deep-seated tumors. I. Studies on thermometry’, Cancer, vol. 60, no. 1, pp. 121–127, Jul. 1987.
[13] N. Cihoric et al., ‘Hyperthermia-related clinical trials on cancer treatment within the Clinicaltrials.gov registry’, Int. J. Hyperthermia, vol. 31, no. 6, pp. 609–614, 2015.
[14] N. M. Reddy, V. Shanta, and S. Krishnamurthi, ‘On minimisation of toxicity to skin during capacitive radio-frequency hyperthermia’, Br. J. Radiol., vol. 59, no. 707, pp. 1129–1131, Nov. 1986.
[15] H. Griffiths, A. Ahmed, and C. W. Smith, ‘Power loss in skin cooling pillows during RF hyperthermia’, Br. J. Radiol., vol. 57, no. 675, pp. 254–256, Mar. 1984.
[16] I. A. Brezovich, M. B. Lilly, J. R. Durant, and D. B. Richards, ‘A practical system for clinical radiofrequency hyperthermia’, Int. J. Radiat. Oncol. Biol. Phys., vol. 7, no. 3, pp. 423–430, Mar. 1981.
[17] R. Zweije, H. P. Kok, A. Bakker, A. Bel, and J. Crezee, ‘Technical and Clinical Evaluation of the ALBA-4D 70MHz Loco-Regional Hyperthermia System’, in 48th European Microwave Conference, 2018, pp. 328–331.
[18] H. P. Kok, D. Correia, M. De Greef, G. Van Stam, A. Bel, and J. Crezee, ‘SAR deposition by curved CFMA-434 applicators for superficial hyperthermia: Measurements and simulations’, Int. J. Hyperthermia, vol. 26, no. 2, pp. 171–184, 2010.
[19] P. Marini, C. Guiot, B. Baiotto, and P. Gabriele, ‘PC-aided assessment of the thermal performances of a MW applicator for oncological hyperthermia’, Comput. Biol. Med., vol. 34, no. 1, pp. 3–13, 2004.
[20] N. Ichinoseki‐Sekine et al., ‘Changes in muscle temperature induced by 434 MHz microwave hyperthermia’, Br. J. Sports Med., vol. 41, no. 7, pp. 425–429, Jul. 2007.
[21] P. Gabriele et al., ‘Radio hyperthermia for re-treatment of superficial tumours’, Int. J. Hyperthermia, vol. 25, no. 3, pp. 189–198, 2009.
[22] H. D. Trefná et al., ‘Quality assurance guidelines for superficial hyperthermia clinical trials: I. Clinical requirements’, Int. J. Hyperthermia, vol. 33, no. 4, pp. 471–482, 2017.
