La hipertermia oncológica es un eficaz radio y quimio sensibilizador, capaz de potenciar los efectos terapéuticos de los fármacos anticancerígenos incluso en células quimiorresistentes. Las mejoras técnicas del equipamiento de hipertermia profunda y la mayor aceptación de las estrategias multimodales para los cánceres de estado avanzado son causa del creciente interés de los oncólogos médicos en la quimio sensibilización lograda con hipertermia.
La hipertermia oncológica consiste en la elevación moderada de temperatura en el rango de 39-45 ºC para obtener un efecto terapéutico debido a la acción quimio y/o radio sensibilizadora de la temperatura1.
Este tratamiento ha evidenciado su capacidad de sensibilización de las células tumorales a la quimioterapia en ensayos in vitro, por medio de distintos mecanismos como el aumento de la perfusión sanguínea del tumor, la permeabilidad de las membranas celulares, y la distribución acelerada de los fármacos. Asimismo, la hipertermia permite superar la quimiorresistencia adquirida por las células cancerígenas a la vez que inhibe su reparación celular del ADN2–4.
La capacidad quimio sensibilizadora de la hipertermia oncológica, verificada en estudios in vitro, se traduce en la efectividad clínica demostrada en diversos ensayos médicos.
Además de esta actividad in vitro, la efectividad de la hipertermia se ha demostrado en diversos ensayos clínicos. De hecho, según Cihoric et al.5 desde el año 2000 hasta septiembre de 2014 se registraron 109 ensayos clínicos en la base de datos pública ClinicalTrials.gov. En otros artículos de revisión, los autores encontraron 32 ensayos aleatorizados de fase III, de los que 23 mostraban el efecto beneficioso de la hipertermia oncológica5.
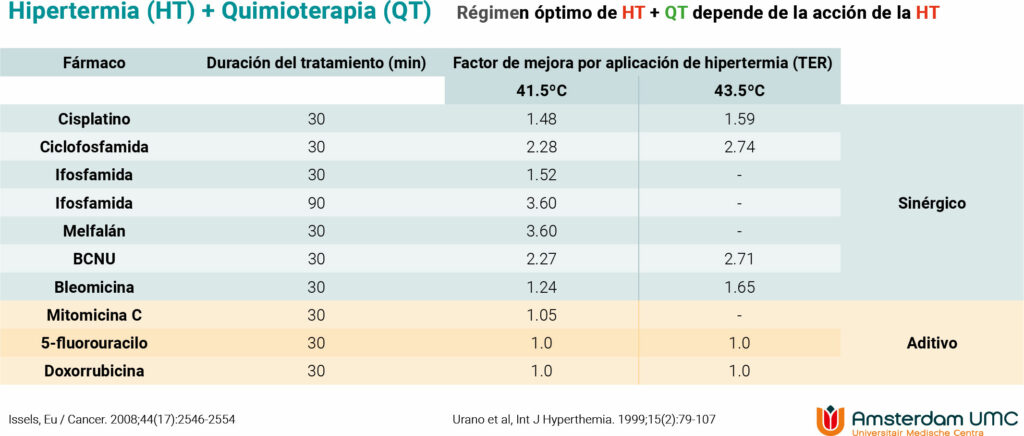
En este artículo discutiremos la evidencia actualmente disponible que avala el uso de hipertermia como adyuvante de la quimioterapia en distintos tipos de cáncer.
Hipertermia en el cáncer de vejiga
El cáncer de vejiga no músculo invasivo (NMIBC, por sus siglas en inglés) supone las tres cuartas partes del total de cánceres de vejiga. La terapia estándar consiste en quimioterapia y/o inmunoterapia, pero resulta subóptima en términos de toxicidad y eficiencia, con un 50% de recidivas. Además, los pacientes de alto riesgo de recidiva son refractarios al tratamiento requiriendo una cistectomía6.
La hipertermia oncológica se investiga como tratamiento adyuvante para reducir la morbilidad, los costes y conseguir la preservación de la vejiga del paciente6. La hipertermia permite conseguir altas temperaturas en la vejiga con una toxicidad aceptable.
El ensayo aleatorizado de Colombo et al. en 20107 analizó los resultados a largo plazo de 83 pacientes de NMIBC. Encontraron que la tasa de recidiva en el grupo que recibió la terapia combinada de hipertermia y quimioterapia fue del 40% frente al 80% del grupo control. Asimismo, la supervivencia libre de enfermedad a 10 años fue del 53% para la terapia combinada frente a un 15% en el grupo control. Igualmente, la tasa de preservación de la vejiga fue del 86% en el grupo experimental y del 79% para el tratamiento estándar.
Los resultados actualmente disponibles refuerzan el uso de la hipertermia oncológica como adyuvante de la quimioterapia para cáncer de vejiga (NMIBC y MIBC)
Los estudios realizados hasta la fecha muestran que la hipertermia resultaría efectiva en NMIBC y también para el cáncer de vejiga músculo invasivo (MIBC, por sus siglas en inglés)6.
Cáncer de esófago
Un estudio de fase I/II de 20048 investigó la viabilidad de la llamada hipertermia profunda para el tratamiento del carcinoma operable de esófago. Cuando se consiguió una temperatura apropiada en el esófago, se aplicó la hipertermia junto con quimioterapia. La elevada toxicidad fue comparable a la de la quimioterapia administrada de forma exclusiva.
En un ensayo aleatorizado previo de Sugimachi et al..9 se evaluó la efectividad de la hipertermia profunda como adyuvante de quimio y radioterapia preoperatorias a la esofagectomía parcial. La efectividad, determinada según la evidencia histopatológica, mostró una destrucción de células cancerosas del 25.9% frente al 7.7% del grupo control. Además, los pacientes reportaron una mejora sustancial en los síntomas (disfagia y volumen de comida tolerado oralmente).
Cáncer de pulmón
El estudio de fase II de Shen et al. de 201110 incluyó 80 pacientes de cáncer de pulmón de células no pequeñas. Todos los pacientes recibieron quimioterapia, y los del grupo experimental también hipertermia como adyuvante. Si bien no se reportaron diferencias significativas entre ambos grupos de pacientes en la tasa de respuesta, sí se encontró una mejora evidente en la calidad de vida de los pacientes que recibieron la terapia combinada.
Sarcoma de tejido blando
El ensayo clínico EORTC 62961-ESHO 95 es el primer estudio aleatorizado de hipertermia oncológica como adyuvante de quimioterapia preoperatoria en pacientes con sarcoma de tejido blando11. Se trata de un estudio multicentro de fase III con 341 pacientes aleatorizados en dos grupos: el experimental que recibió quimioterapia e hipertermia, y el grupo control al que solo se le administró quimioterapia.
Tras el tratamiento preoperatorio, se realizó la cirugía de resección y cerca de un 60% de los pacientes de cada grupo recibió radioterapia posoperatoria con o sin hipertermia. Según el grupo de estudio, se administró nuevamente quimioterapia posoperatoria con o sin hipertermia.
El estudio multicentro de fase III EORTC 62961-ESHO 95 demostró la efectividad de la hipertermia en la tasa de supervivencia a 5 años, 10 años y la supervivencia libre de progresión en el tratamiento de sarcoma de tejido blando.
Tal como recogen Issels et al. de 201012 la progresión local o muerte fue mayor en el grupo control. La supervivencia libre de enfermedad también mejoró en el grupo experimental.
En Issels et al. de 201811 se recogieron los resultados a largo plazo de este ensayo, para evaluar si la mejora reportada previamente12 se traducía en mayor supervivencia. Este estudio contó con 329 pacientes, de los que 220 (67%) tuvieron una recaída y 188 (57%) fallecieron.
La hipertermia aumentó la tasa de supervivencia a 5 años (62.7% frente al 51.3% del grupo control), y a 10 años (52.6% frente al 42.7%), mejorando también la supervivencia libre de progresión. Por esto, se recomienda incorporar la hipertermia oncológica en el tratamiento de sarcomas de tejido blando de alto riesgo en pacientes seleccionados.
Oncología pediátrica
La hipertermia tiene un potencial especialmente elevado en la oncología pediátrica, donde la quimioterapia actual ha alcanzado la máxima tolerabilidad y la corta edad de los pacientes implica riesgos significativos de efectos secundarios a largo plazo13.
El estudio de fase II de Wessalowski et al.14 constituye el ensayo con mayor número de pacientes pediátricos (44 pacientes con edades comprendidas de los 7 meses a los 21 años). Dichos pacientes tenían un diagnóstico de recidiva de tumores de células germinales y fueron tratados con hipertermia y quimioterapia. Debido al reducido número de pacientes por año y no disponer de otro tratamiento, no se realizó la aleatorización del ensayo.
A los pacientes se les administró un 20% menos de la dosis estándar de cisplatino, para prevenir la toxicidad. Sin embargo, y a pesar de esta reducción de dosis, se obtuvo una respuesta objetiva del 86%, una supervivencia libre de eventos a 5 años del 62% y una supervivencia global del 72%. Se trata de resultados bastante superiores a los habituales en recidiva de tumores de células germinales en pacientes pediátricos14. Además, la hipertermia no supuso un aumento significativo de la toxicidad del tratamiento13.
Por todo ello, los autores concluyeron que la hipertermia debería aplicarse lo más pronto posible en recidivas14,15 y que esta terapia podría convertirse en un tratamiento de primera línea para el tratamiento de tumores pediátricos complejos14.
Cáncer de ovario
Fotopoulou et al. reportaron en 201016 un estudio con pacientes con recidiva de carcinoma epitelial de ovario, siendo 29 de ellas platino-resistentes y 7 platino-sensibles. Todas recibieron quimioterapia sistémica en combinación con hipertermia.
Las tasas de toxicidad encontradas para la hipertermia fueron aceptables y se correspondían con las típicas de la quimioterapia. Por tanto, se demostró que tanto la quimioterapia basada en platino como la quimioterapia sin platino pueden combinarse de forma segura con hipertermia en pacientes pretratadas que sufren recidivas de cáncer de ovario.
La tasa de respuesta global fue similar a la obtenida con el tratamiento estándar, encontrándose una relación entre la dosis térmica administrada y la tasa de respuesta. Las metástasis distantes localizadas en la cavidad abdominal también se beneficiaron de la hipertermia local.
La conclusión del estudio es que se requieren nuevos ensayos de fase III que prueben la eficacia de la hipertermia para superar la quimiorresistencia e incrementar la respuesta a la quimioterapia en recidivas de ovario.
Cáncer de páncreas
El cáncer de páncreas presenta un microambiente hipóxico que le confiere resistencia a la quimio y radioterapia. Por ello, la hipertermia profunda es una excelente candidata para mejorar el escaso efecto terapéutico de estos tratamientos17.
Una revisión sistemática de 201817 incluyó 14 estudios con un total de 395 pacientes, de los cuales 248 recibieron hipertermia como terapia adyuvante. Seis de estos estudios contaban con grupo control.
Todos los ensayos reportaron un incremento de la mediana de supervivencia global en las cohortes que recibieron hipertermia frente a los grupos control. Estos resultados sugieren que la hipertermia podría aumentar la tasa de respuesta y la supervivencia global de los pacientes de cáncer de páncreas.
El ensayo aleatorizado HEAT, actualmente en marcha, busca corroborar la evidencia clínica disponible de la efectividad de la hipertermia en cáncer de páncreas.
Sin embargo, debe tenerse en cuenta que la calidad de los estudios revisados es limitada dado que ninguno estaba aleatorizado. Por esto se encuentra actualmente en marcha el ensayo aleatorizado HEAT (Hyperthermia European Adjuvant Trial) para pacientes con carcinoma pancreático extirpado18.
Carcinomatosis peritoneal
La carcinomatosis peritoneal es la diseminación intraperitoneal de cualquier tipo de cáncer no originado en el propio peritoneo19, siendo también un estadio de mala prognosis en las neoplasias ginecológicas y gastrointestinales20.
En ausencia de otras metástasis sistémicas, el tratamiento (cirugía citorreductora y quimioterapia intraperitoneal hipertérmica HIPEC), consigue aumentar el control locorregional y la supervivencia. Sin embargo, es un procedimiento invasivo, largo y complejo que requiere que los pacientes estén en buenas condiciones clínicas19. Además, no se dispone de tratamiento estándar para los distintos tipos de recidiva20.
En el estudio de fase I/II, reportado por Cho et al. en 200820, se evaluó la hipertermia oncológica regional para pelvis y abdomen. El ensayo contó con 45 pacientes con carcinomatosis peritoneal, con y sin metástasis hepáticas. Todos ellos recibieron quimioterapia estándar e hipertermia.
La hipertermia abdominal fue bien tolerada en comparación con otras alternativas como la cirugía citorreductora o la quimioterapia intraperitoneal. La tasa de respuesta global, que incluye tanto la paliación de síntomas como la respuesta bioquímica, fue del 68.7% para todos los ciclos de quimioterapia20.
La evidencia clínica disponible avala el uso de la hipertermia como complemento seguro, viable y valioso de la quimioterapia en distintos tipos de cáncer, como los de vejiga, esófago, pulmón, sarcoma de tejido blando, oncología pediátrica, ovario, páncreas y carcinoma peritoneal.
En resumen, los estudios clínicos comentados avalan el uso de la hipertermia como complemento seguro, viable y valioso de la quimioterapia en distintos tipos de cáncer, tal como concluye la revisión de Datta et al.3 de 2015.
En el apartado siguiente, presentaremos el sistema ALBA 4D de Medlogix, resaltando por qué es el más indicado para conseguir la calidad óptima del tratamiento de hipertermia profunda.
ALBA, la mejor tecnología de hipertermia oncológica
La dosis térmica es el parámetro clave para la efectividad de la hipertermia17. Por ello, la calidad del tratamiento debe garantizarse mediante la adecuada tecnología del equipo de hipertermia20. En este sentido, los innovadores sistemas ALBA de Medlogix, instalados en numerosos hospitales, son fruto de la colaboración científico-técnica con centros de excelencia investigadora, que certifican sus características avanzadas.
El sistema de hipertermia profunda ALBA 4D está indicado para el tratamiento de cáncer de ovario, vejiga (tanto NMIBC como MIBC), sarcoma de tejido blando, esófago, páncreas, tumores pediátricos y carcinomatosis peritoneal, entre otros.
ALBA 4D, desarrollado con la colaboración del Academic Medical Center (AMC) de Ámsterdam, consiste en cuatro antenas en fase que trabajan a 70 MHz produciendo cuatro haces modulables de forma independiente para focalizar la energía en los tumores de cualquier profundidad y localización en pelvis, abdomen y extremidades.
El sistema de hipertermia profunda ALBA 4D excede las demandas técnicas más exigentes para asegurar un tratamiento óptimo y efectivo por medio del escalado de la dosis térmica con alta precisión, velocidad y temperatura en el tumor.
La tecnología de ALBA 4D consigue un escalado de dosis térmica con alta precisión, velocidad y temperatura en el tumor, cumpliendo con los criterios de calidad de la Sociedad Europea de Hipertermia Oncológica (ESHO, por sus siglas en inglés) y garantizando la aplicación del mejor tratamiento de hipertermia profunda19,21–23.
La hipertermia oncológica actúa sinérgicamente con la quimio y radioterapia sin sumar efectos secundarios importantes15. El sistema de hipertermia profunda ALBA 4D de Medlogix excede las demandas técnicas más exigentes para asegurar la optimización del tratamiento.
Si desea más información acerca de la hipertermia oncológica de ALBA 4D, puede contactarnos en el siguiente enlace.
Referencias
1. van der Zee, J., Vujaskovic, Z., Kondo, M. & Sugahara, T. The Kadota Fund International Forum 2004-Clinical group consensus. Int. J. Hyperth. 24, 111–122 (2008).
2. Hildebrandt, B. et al. The cellular and molecular basis of hyperthermia. Crit. Rev. Oncol. Hematol. 43, 33–56 (2002).
3. Datta, N. R. et al. Local hyperthermia combined with radiotherapy and-/or chemotherapy: Recent advances and promises for the future. Cancer Treat. Rev. 41, 742–753 (2015).
4. Issels, R. Hyperthermia Combined with Chemotherapy-Biological Rationale, Clinical Application, and Treatment Results.Onkologie 22, 374–381 (1999).
5. Cihoric, N. et al. Hyperthermia-related clinical trials on cancer treatment within the ClinicalTrials.gov registry. Int. J. Hyperth. 31, 609–614 (2015).
6. Longo, T. A. et al. A systematic review of regional hyperthermia therapy in bladder cancer. Int. J. Hyperth. 32, 381–389 (2016).
7. Colombo, R., Salonia, A., Leib, Z., Pavone-Macaluso, M. & Engelstein, D. Long-term outcomes of a randomized controlled trial comparing thermochemotherapy with mitomycin-C alone as adjuvant treatment for non-muscle-invasive bladder cancer (NMIBC). BJU Int. 107, 912–918 (2010).
8. Albregts, M. et al. A feasibility study in oesophageal carcinoma using deep loco-regional hyperthermia combined with concurrent chemotherapy followed by surgery. Int. J. Hyperth. 20, 647–659 (2004).
9. Sugimachi, K. et al. Hyperthermia combined with chemotherapy and irradiation for patients with carcinoma of the oesophagus-a prospective randomized trial. Int. J. Hyperth. 8, 289–295 (1992).
10. Shen, H. et al. The regimen of gemcitabine and cisplatin combined with radio frequency hyperthermia for advanced non-small cell lung cancer: A phase II study. Int. J. Hyperth. 27, 27–32 (2011).
11. Issels, R. D. et al. Effect of Neoadjuvant Chemotherapy Plus Regional Hyperthermia on Long-term Outcomes Among Patients With Localized High-Risk Soft Tissue Sarcoma The EORTC 62961-ESHO 95 Randomized Clinical Trial. JAMA Oncol.4, 483–492 (2018).
12. Issels, R. D. et al. Neo-adjuvant chemotherapy alone or with regional hyperthermia for localised high-risk soft-tissue sarcoma: a randomised phase 3 multicentre study. Lancet Oncol. 11, 561–570 (2010).
13. Tydings, C., Sharma, K. V., Kim, A. & Yarmolenko, P. S. Emerging hyperthermia applications for pediatric oncology. Adv. Drug Deliv. Rev. 163–164, 157–167 (2020).
14. Wessalowski, R. et al. Regional deep hyperthermia for salvage treatment of children and adolescents with refractory or recurrent non-testicular malignant germ-cell tumours: An open-label, non-randomised, single-institution, phase 2 study. Lancet Oncol. 14, 843–852 (2013).
15. Seifert, G. et al. Regional hyperthermia combined with chemotherapy in paediatric, adolescent and young adult patients: Current and future perspectives. Radiat. Oncol. 11, 1–7 (2016).
16. Fotopoulou, C. et al. Regional abdominal hyperthermia combined with systemic chemotherapy for the treatment of patients with ovarian cancer relapse: Results of a pilot study. Int. J. Hyperth. 26, 118–126 (2010).
17. van der Horst, A. et al. The clinical benefit of hyperthermia in pancreatic cancer: a systematic review. Int. J. Hyperth. 34, 969–979 (2018).
18. Issels, R. Hyperthermia European Adjuvant Trial (HEAT). ClinicalTrials.gov https://clinicaltrials.gov/ct2/show/NCT01077427.
19. Kok, H. P. et al. Locoregional peritoneal hyperthermia to enhance the effectiveness of chemotherapy in patients with peritoneal carcinomatosis: a simulation study comparing different locoregional heating systems. Int. J. Hyperth. 37, 76–88 (2020).
20. Cho, C. H. et al. Regional hyperthermia of the abdomen in conjunction with chemotherapy for peritoneal carcinomatosis: Evaluation of two annular-phased-array applicators. Int. J. Hyperth. 24, 399–408 (2008).
21. Zweije, R., Kok, H. P., Bakker, A., Bel, A. & Crezee, J. Technical and Clinical Evaluation of the ALBA-4D 70MHz Loco-Regional Hyperthermia System. in 48th European Microwave Conference 328–331 (European Microwave Association, 2018). doi:10.23919/EuMC.2018.8541673.
22. Kok, H. P., Navarro, F., Strigari, L., Cavagnaro, M. & Crezee, J. Locoregional hyperthermia of deep-seated tumours applied with capacitive and radiative systems: a simulation study. Int. J. Hyperth. 34, 714–730 (2018).
23. Bruggmoser, G. et al. Guideline for the clinical application, documentation and analysis studies for regional deep hyperthermia. Strahlentherapie und Onkol. 188, 198–211 (2012).