La Física médica de la hipertermia oncológica y el control de calidad son las protagonistas de la tercera entrega de la serie de Hipertermia oncológica: ¿cuál es el único camino hacia el tratamiento de calidad?. En ella, presentamos los aspectos necesarios de la terapia, entre los que destaca el papel del radiofísico en la consecución de un tratamiento de calidad. Con la nueva entrega proseguimos el ejercicio de reflexión sobre cómo debería ser la hipertermia del presente y del futuro.
La hipertermia oncológica se utiliza de terapia adyuvante de la radioterapia y/o quimioterapia. Consiste en el calentamiento de los tumores entre los 39-45 °C durante una hora con el objetivo de mejorar la efectividad del tratamiento primario[1].
La serie de artículos surge a raíz del webinar realizado en colaboración con la Sociedad Española de Física Médica (SEFM).
En el primer artículo de esta serie tratamos de los mecanismos de acción y de los aspectos más relevantes (sobre todo la alta temperatura en el tumor [2] y el intervalo de tiempo corto entre hipertermia y radioterapia[3]). También se introdujeron las dos tecnologías más comunes en el mercado: capacitiva y radiativa.
En el segundo artículo exploramos las diferencias entre estas tecnologías por medio de las publicaciones de Kok et al.[4], [5]. Ambas contienen simulaciones numéricas de hipertermia profunda y superficial en distintas condiciones. Esto contribuyó con información valiosa sobre qué tecnología proporciona mejor temperatura.
Este tercer artículo se centra en la Física médica de la hipertermia oncológica desde las directrices de control de calidad de hipertermia oncológica de la ESHO (European Society for Hyperthermic Oncology). Estas buscan establecer la estandarización: un nivel de calidad único y uniforme en los tratamientos de hipertermia de todos los estudios multinstitucionales [6]. De esta forma, se garantiza un método comparable a nivel internacional para la terapia y los análisis consiguientes de los resultados del tratamiento [7].
Directrices de la ESHO de control de calidad de hipertermia oncológica
La ESHO dispone de directrices de control de calidad para hipertermia profunda[8], [9] e hipertermia superficial[6], [7]. Provienen de la experiencia práctica de muchos centros europeos y norteamericanos de hipertermia[7]. Por tanto, la validez es a nivel internacional.
Una premisa fundamental es que la eficacia demostrada en ensayos clínicos depende en exclusiva del efecto térmico sobre los tumores. Este es función de la temperatura alcanzada y del tiempo de tratamiento[2], [3], [10]–[16]. Asimismo, también hay correlación entre la toxicidad y los parámetros térmicos[6]. De hecho una elevada dosis térmica puede incluso provocar citotoxicidad directa o destrucción de las células cancerosas.
Por tanto, la hipertermia superficial y la profunda deben administrarse mediante sistemas con la capacidad técnica de calentamiento controlado de un volumen objetivo específico al intervalo de temperatura hipertérmica tal como requieren las directrices y la comunidad científica. Los equipos también deben ser capaces de controlar el calentamiento de forma local y también minimizar la dosis a los tejidos normales críticos [6], [9].
El control de calidad forma parte de los aspectos físicos y técnicos del sistema de hipertermia oncológica. Por eso, las directrices establecen que es responsabilidad del radiofísico hospitalario con la suficiente formación [6], [9].
A continuación, comentamos las directrices de control de calidad de la ESHO de hipertermia superficial[6], [7] y profunda[8], [9]. Además, tratamos de cómo los dispositivos de hipertermia radiativa ALBA de Med-Logix se adecúan a ellas para aplicar y registrar de forma apropiada los tratamientos.
Med-Logix dispone del sistema de hipertermia radiativa multiprofunda (superficial y semiprofunda) ALBA ON 4000D y del sistema radiativo de hipertermia profunda ALBA 4D. Este fabricante ha desarrollado herramientas especializadas de control de calidad que cumplen las directrices completas de la ESHO[6], [7], [9], [17]. Por tanto, garantizan un alto nivel de calidad a lo largo del tiempo.
Hipertermia superficial: directrices de control de calidad de la ESHO
La hipertermia superficial se dirige a los tumores desde la piel a las capas de tejido cutáneo. El mínimo es alcanzar una T90 de 40 °C durante 60 minutos y una T50 que exceda los 41 °C en el volumen objetivo. Asimismo, se considera aceptable una temperatura máxima en el tejido normal de 43–45 °C. Esto representa una dosis térmica CEM43T90 cercana a 1 por cada sesión de hipertermia[6].
Las directrices de control de calidad de la ESHO para el tratamiento de hipertermia superficial se describen en dos documentos: el de requisitos clínicos [6] y el de requisitos técnicos [7]. En cuanto a los requisitos técnicos, las directrices explicitan un estándar de mínimo rendimiento referido a un incremento mínimo de temperatura de 6 °C en 6 minutos a 1 cm de profundidad de un fantoma equivalente a músculo[7]. Todos los dispositivos de hipertermia (sean radiativos o capacitivos) deben respetar este criterio.
La ESHO reconoce los sistemas electromagnéticos (radiativos y capacitivos), infrarrojos y de ultrasonidos para el calentamiento de algunos tumores superficiales. Sin embargo, especifica que cada dispositivo tiene ventajas y limitaciones propias con respecto a los tumores que puede calentar de forma adecuada. Las diferencias de rendimiento se refieren a la extensión lateral y profundidad de calentamiento, la viabilidad de control espacial, la ubicación, los requisitos de contacto o acoplamiento, etc. [6].
En las directrices se menciona la importancia de gestionar la aplicación de hipertermia capacitiva debido al calentamiento preferencial de la capa de grasa[6], tal como tratábamos en el anterior artículo de esta serie [4], [5], [18].
Las directrices especifican un estándar de mínimo rendimiento referido a un incremento mínimo de temperatura de 6 °C en 6 minutos a 1 cm de profundidad de un fantoma equivalente a músculo. Todos los dispositivos de hipertermia (sean radiativos o capacitivos) deben respetar este criterio.
Las directrices de la ESHO incluyen indicaciones sobre el patrón térmico espacial de los aplicadores, el bolus de agua, la termometría, la planificación del tratamiento, entre otros [6], [7].
Aplicador de hipertermia superficial
El patrón térmico espacial del aplicador debe evaluarse bajo condiciones reguladas antes de su primer uso clínico y a intervalos periódicos dentro del programa de control de calidad. La distribución térmica también debe caracterizarse en las condiciones estandarizadas de operación y en las frecuencias de uso. En este sentido se utilizan dos configuraciones genéricas de fantomas de referencia: enfermedad superficial de la pared torácica y tumores a una profundidad moderada por debajo de la piel y la grasa[7].
Med-Logix ofrece una línea completa de productos de control de calidad, con soluciones para las comprobaciones de control de calidad de la ESHO y el cumplimiento total de sus directrices. Para estos test Med-Logix cuenta con un fantoma sólido de la pared torácica de control de calidad. El contenido del fantoma reproduce las propiedades electromagnéticas del material equivalente a músculo a la frecuencia de trabajo de ALBA ON 4000D (434 MHz). El fantoma se equipa con múltiples catéteres integrados que permiten las mediciones de temperatura en tiempo real a profundidades de 1 y 6 cm. A 1 cm de profundidad posibilita la verificación del criterio de aumento de temperatura de 6 °C en 6 min de calentamiento. Además, se incluyen sensores adiciones con el objetivo de determinar la profundidad de penetración del aplicador estudiado.
Las configuraciones de control de calidad también trabajan con un módulo en el software de ALBA ON 4000D, donde el operador puede realizar y recoger los datos de evaluación de manera sencilla (gráficas de temperatura, profundidad de penetración, distribución de campo eléctrico).
Como solución avanzada adicional, Med-Logix dispone de un sistema que mide el campo eléctrico de la antena. La configuración engloba MLX 3D E-SCAN, MLX E-PROBE y fantoma líquido. El conjunto permite un mapeo espacial de alta resolución del campo eléctrico y genera de modo automático la visualización 3D completa de la distribución del campo. Esta medición del campo eléctrico posibilita el cálculo de SAR.

En ALBA ON 4000D, los aplicadores solían colocarse de forma manual con el movimiento del brazo mecánico del dispositivo. No obstante, esto podía causar pequeños desajustes entre tratamientos.
Por eso, Med-Logix desarrolló la guía óptica ALBA OPTIX que asegura la exactitud y repetibilidad de las distintas sesiones de hipertermia [19], [20]. Este sistema de posicionamiento permite visualizar y seguir al aplicador en tiempo real con respecto a la reconstrucción de la imagen TC del paciente. Esto facilita la configuración precisa y exacta de la antena en las coordenadas del volumen objetivo (GTV/CTV/PTV). Así se asegura que la máxima SAR coincida por completo con el isocentro y se alcance una elevada temperatura.
Bolus de agua
La función del bolus de agua circulante con control de temperatura es adaptar la superficie rígida, curva o plana, de un aplicador a los contornos irregulares del tejido del paciente. Así, se acopla de manera eficiente la energía electromagnética (tecnologías radiativa y capacitiva) al paciente y se controla la temperatura de la superficie de la piel[6].
La temperatura del agua en el bolus proporciona un parámetro de control adicional que modula en cierta medida la profundidad de calentamiento. Se recomienda reducir la temperatura del bolus de forma que se mantenga una temperatura superficial más baja. El objetivo es proteger la piel y aplicar niveles de potencia más altos que mejoren el calentamiento en ubicaciones más profundas [6].
En la tecnología radiativa, el bolus de agua debe llenarse con agua desionizada con un ajuste de temperatura mínimo en el intervalo de 30–45 °C [6]. En el caso de ALBA ON 4000D de Med-Logix, las antenas microstrip tienen el bolus integrado para calentar de forma efectiva los objetivos, en el intervalo de temperatura de 41-43 °C durante 60 minutos, como requieren las directrices de la ESHO [6]
Por otro lado, en los sistemas capacitivos se recomienda el uso de agua salina (0.1–1.5%) porque parece mejorar la impedancia entre los electrodos y el tejido muscular. Además, colabora en la distribución de las corrientes de radiofrecuencia en toda la zona de contacto. Esto permite reducir fenómeno muy frecuente de riesgo de quemaduras cutáneas bajo los bordes de un electrodo[6]. No obstante, a pesar de la optimización con bolus salino [5], [21]–[23], la simulación de Kok and Crezee [5] demostró que los puntos calientes son un problema clínico en la tecnología capacitiva en el caso de anatomías heterogéneas.
Termometría
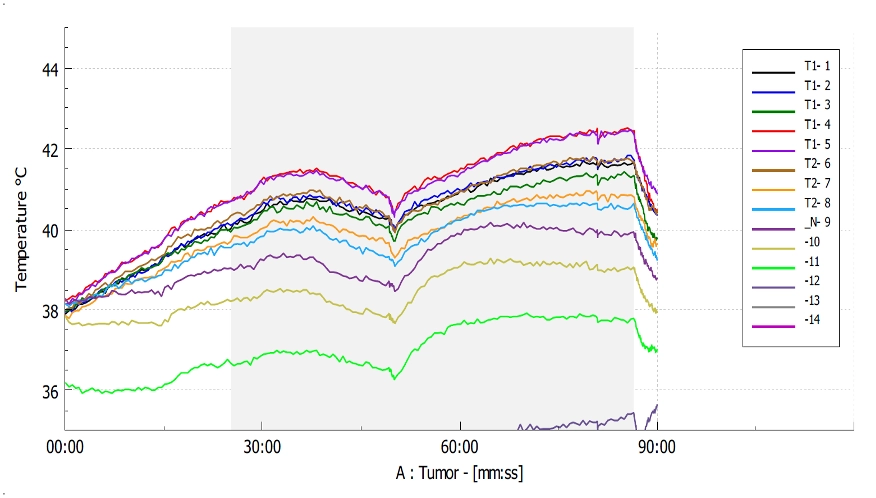
La monitorización de la dosis térmica administrada al tumor es crucial en el control y evaluación de la calidad del tratamiento. Los sensores de termometría deben colocarse en la piel y/o de forma intersticial en el mayor número de sitios posibles. Así, se pueden muestrear ubicaciones representativas por todo el objetivo. Además, también deben monitorizarse las que tengan un riesgo mayor de puntos calientes o fríos (por ejemplo, cicatrices)[6].
El número mínimo de ubicaciones de medición de temperatura es 5, con un ciclo de lectura de al menos una vez por minuto. En el caso de tumores a más de 1 cm de profundidad, se recomienda la colocación de uno o más sensores intersticiales. Si los catéteres de termometría invasiva se contraindican, la temperatura en profundidad debe estimarse usando la potencia del aplicador, la temperatura del bolus de agua y la de la piel. La estimación se obtiene de la planificación del tratamiento o de directrices genéricas de la literatura [6].
Med-Logix dispone de kit de calibración termométrica, aprobado por la ESHO. Es necesario en el procedimiento de calibración del sistema termométrico (termómetro y sensores de temperatura) con una exactitud de +/- 0.2°C. En el sistema de termometría de ALBA ON 4000D, se incluyen 64 sensores (considerando la matriz), es decir, más de ocho veces el mínimo recomendado por la ESHO [7], [24].
Planificación del tratamiento
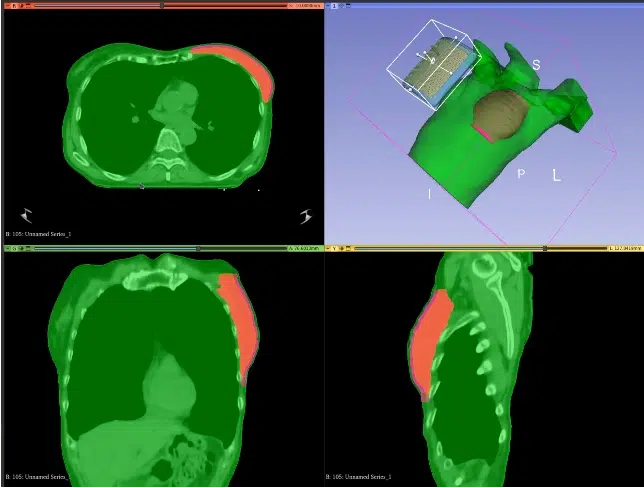
La planificación de la hipertermia puede ser útil en situaciones que se desvían de la norma. En la actualidad, la planificación superficial se realiza en unos pocos centros académicos. En ellos se estudian casos de pacientes específicos con validación (siempre que sea posible) de SAR predicho/distribución de temperatura con medidas durante el tratamiento [6].
En la planificación de la hipertermia superficial es importante el posicionamiento exacto del aplicador con respecto al volumen objetivo de tejido. Debe producirse la correspondencia perfecta entre la anatomía modelada y el aplicador con la configuración clínica real. Así, se obtiene una orientación fiable de la distribución de SAR en el paciente [6].
Hipertermia profunda: directrices de control de calidad
Las directrices de calidad de hipertermia profunda [8], [9] están reconocidas por la ESHO y la STM (Estados Unidos). Se utilizan como (pre)estándar que asegura la aplicación y registro del tratamiento de acuerdo al conocimiento actualizado y la experiencia tecnológica y clínica[9].
Estas directrices contienen normas de implementación de medidas de control de calidad dentro de su gestión en hipertermia profunda. El objetivo es garantizar un método comparable y rastreable del procedimiento [9].
En hipertermia profunda el estándar de rendimiento mínimo exige un incremento mínimo de temperatura de 10 °C en 6 minutos en el centro del fantoma equivalente a músculo.
Los tratamientos de hipertermia profunda deben llevarse a cabo con dispositivos con la capacidad técnica de calentar de modo controlado un volumen objetivo específico, definido por imagen (TC, RM), mientras se evita el tejido normal. Esto solo puede conseguirse irradiando y enfocando ondas electromagnéticas sobre el volumen objetivo. Además, dado que en el mundo occidental los pacientes suelen tener una capa de grasa superficial superior a 2 cm, la única tecnología capaz de calentar tumores profundos es la hipertermia radiativa [4], [9]. Por eso, las directrices de la ESHO se dirigen en exclusiva a esta tecnología [9].
Por otra parte, se requiere el registro directo de la temperatura en el volumen objetivo o en el tejido circundante de cara a la calidad del tratamiento [9].
En hipertermia profunda el estándar de rendimiento mínimo exige un incremento mínimo de temperatura de 10 °C en 6 minutos en el centro del fantoma equivalente a músculo.
Las directrices recogen la preparación, el tratamiento y la documentación, análisis y auditorías. En la preparación, se utiliza el volumen objetivo de hipertermia para definir el punto óptimo y posicionar al paciente en el centro del aplicador [9].
Dentro del tratamiento se incluye también el posicionamiento del paciente, el enfriamiento, el control del bolus, la termometría (bien con sondas de temperatura o con RM), el control de la aplicación del tratamiento con sondas de campo eléctrico, la colocación de catéter y la planificación[9].
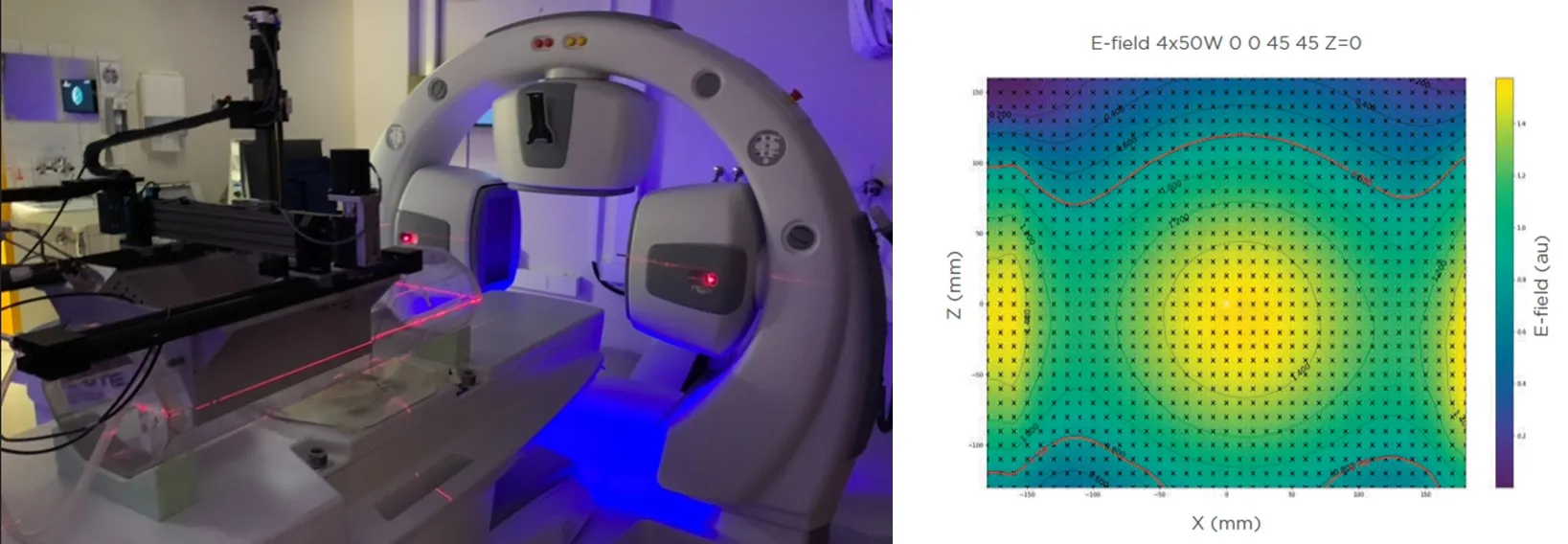
Igual que en el sistema ALBA ON 4000D, Med-Logix dispone de herramienta de medición del campo eléctrico del haz 3D de la antena de ALBA 4D. Se diseñó para comprobar y verificar el funcionamiento de la antena de hipertermia en fantoma líquido equivalente a músculo. Esto permite la evaluación cualitativa del haz 3D de la antena en cuanto a la zona de foco geométrico, la capacidad de dirección focalizada, la dirección del foco y la verificación cualitativa de la simulación de la planificación del tratamiento.
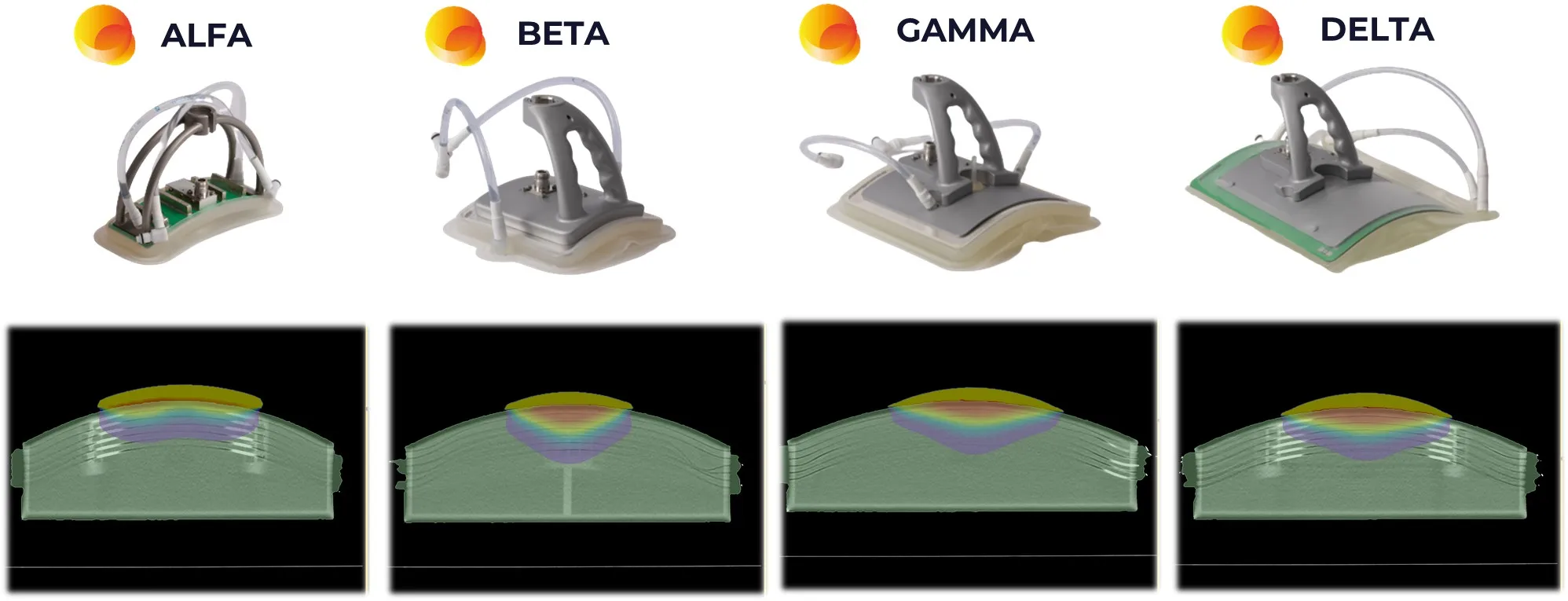
Med-Logix cuenta con un fantoma de matriz LED para test cualitativos rápidos. Tiene forma elíptica y simula una sección transversal del torso humano. Se diseñó con el objeto de mostrar en tiempo real la dirección de foco resultado del ajuste de amplitud y fase de las antenas. La salida de luz de los LED es proporcional a la fuerza del campo eléctrico local generada por los anillos de radiofrecuencia.
Med-Logix dispone de kit de calibración termométrica para ALBA 4D, cumpliendo las directrices de la ESHO.

En las directrices[9], se trata también la documentación de la parte físico-técnica y la clínica. Además, estandariza el análisis de los datos físicos y técnicos [9].
Las directrices de control de calidad del tratamiento de hipertermia oncológica superficial y profunda de la ESHO muestran la importancia que concede la institución a la calidad de esta terapia adyuvante. De acuerdo a las mismas, Med-Logix ha desarrollado las herramientas necesarias de control de calidad de los sistemas ALBA ON 4000D y ALBA 4D.
En la siguiente entrega de esta serie continuaremos con la física médica, en concreto, cómo asimilar el flujo de trabajo de la hipertermia oncológica a la radioterapia. Si busca más información sobre la tecnología radiativa, puede visualizar la grabación bajo demanda del webinar organizado en colaboración con la SEFM.
Le invitamos también a suscribirse a la newsletter bimestral en la que recibirá noticias de próximas publicaciones de esta serie de Hipertermia oncológica: ¿cuál es el camino hacia el tratamiento de calidad? Puede contactarnos en el siguiente enlace.
Referencias
[1] J. van der Zee, Z. Vujaskovic, M. Kondo, and T. Sugahara, ‘The Kadota Fund International Forum 2004-Clinical group consensus’, Int. J. Hyperthermia, vol. 24, no. 2, pp. 111–122, 2008.
[2] A. Bakker et al., ‘Post-operative re-irradiation with hyperthermia in locoregional breast cancer recurrence: Temperature matters’, Radiother. Oncol., vol. 167, pp. 149–157, 2022.
[3] C. M. van Leeuwen et al., ‘A short time interval between radiotherapy and hyperthermia reduces in-field recurrence and mortality in women with advanced cervical cancer’, Radiat. Oncol., vol. 12, no. 75, 2017.
[4] H. P. Kok, F. Navarro, L. Strigari, M. Cavagnaro, and J. Crezee, ‘Locoregional hyperthermia of deep-seated tumours applied with capacitive and radiative systems: a simulation study’, Int. J. Hyperthermia, vol. 34, no. 6, pp. 714–730, Aug. 2018.
[5] H. P. Kok and J. Crezee, ‘A comparison of the heating characteristics of capacitive and radiative superficial hyperthermia’, Int. J. Hyperthermia, vol. 33, no. 4, pp. 378–386, May 2017.
[6] H. D. Trefná et al., ‘Quality assurance guidelines for superficial hyperthermia clinical trials: I. Clinical requirements’, Int. J. Hyperthermia, vol. 33, no. 4, pp. 471–482, 2017.
[7] H. Trefná Dobšíček et al., ‘Quality assurance guidelines for superficial hyperthermia clinical trials II. Technical requirements for heating devices’, Strahlenther. Onkol., vol. 193, pp. 351–366, 2017.
[8] G. Bruggmoser, ‘Some aspects of quality management in deep regional hyperthermia’, Int. J. Hyperthermia, vol. 28, no. 6, pp. 562–569, Aug. 2012.
[9] G. Bruggmoser et al., ‘Guideline for the clinical application, documentation and analysis studies for regional deep hyperthermia’, Strahlenther. Onkol., vol. 188, no. SUPPL. 2, pp. 198–211, 2012.
[10] Y. Hua, S. Ma, Z. Fu, Q. Hu, L. Wang, and Y. Piao, ‘Intracavity hyperthermia in nasopharyngeal cancer: a phase III clinical study’, Int. J. Hyperthermia, vol. 27, no. 2, pp. 180–186, 2011.
[11] R. D. Issels, ‘Hyperthermia adds to chemotherapy’, Eur. J. Cancer, vol. 44, no. 17, pp. 2546–2554, 2008.
[12] R. D. Issels et al., ‘Neo-adjuvant chemotherapy alone or with regional hyperthermia for localised high-risk soft-tissue sarcoma: a randomised phase 3 multicentre study’, Lancet Oncol., vol. 11, no. 6, pp. 561–570, June 2010.
[13] R. Wessalowski et al., ‘Regional deep hyperthermia for salvage treatment of children and adolescents with refractory or recurrent non-testicular malignant germ-cell tumours: An open-label, non-randomised, single-institution, phase 2 study’, Lancet Oncol., vol. 14, no. 9, pp. 843–852, 2013.
[14] W. Tilly et al., ‘Regional Hyperthermia in Conjunction with Definitive Radiotherapy against Recurrent or Locally Advanced Prostate Cancer T3 pN0 M0’, Strahlenther. Onkol., vol. 181, pp. 35–41, 2005.
[15] J. Van Der Zee, D. G. González, G. C. Van Rhoon, J. D. P. Van Dijk, and W. L. J. Van Putten, ‘Comparison of Radiotherapy alone with Radiotherapy plus Hyperthermia in Locally Advanced Pelvic Tumors: a prospective, randomised, multicentre trial’, Lancet, vol. 355, pp. 1119–1125, 2000.
[16] J. van der Zee, ‘Heating the patient: a promising approach?’, Ann. Oncol., vol. 13, pp. 1173–1184, Aug. 2002.
[17] R. Zweije, H. P. Kok, A. Bakker, A. Bel, and J. Crezee, ‘Technical and Clinical Evaluation of the ALBA-4D 70MHz Loco-Regional Hyperthermia System’, in 48th European Microwave Conference, 2018, pp. 328–331.
[18] H. P. Kok et al., ‘Locoregional peritoneal hyperthermia to enhance the effectiveness of chemotherapy in patients with peritoneal carcinomatosis: a simulation study comparing different locoregional heating systems’, Int. J. Hyperthermia, vol. 37, no. 1, pp. 76–88, 2020.
[19] M. Ferro, S. Ciampa, F. R. Cappelli, E. Pagliaroli, A. Soriani, and M. Vendittelli, ‘Marker-based registration for antenna positioning in superficial hyperthermia’, in 13th International Congress of Hyperthermic Oncology, 2021.
[20] M. Ferro, M. Vendittelli, S. Ciampa, and P. Pavoni, ‘Towards an image-guided positioning system for radiative applicators in oncological hyperthermia’. Zenodo, 18-Oct-2019.
[21] N. M. Reddy, V. Shanta, and S. Krishnamurthi, ‘On minimisation of toxicity to skin during capacitive radio-frequency hyperthermia’, Br. J. Radiol., vol. 59, no. 707, pp. 1129–1131, Nov. 1986.
[22] H. Griffiths, A. Ahmed, and C. W. Smith, ‘Power loss in skin cooling pillows during RF hyperthermia’, Br. J. Radiol., vol. 57, no. 675, pp. 254–256, Mar. 1984.
[23] I. A. Brezovich, M. B. Lilly, J. R. Durant, and D. B. Richards, ‘A practical system for clinical radiofrequency hyperthermia’, Int. J. Radiat. Oncol. Biol. Phys., vol. 7, no. 3, pp. 423–430, Mar. 1981.
[24] A. Bakker et al., ‘Analysis of clinical data to determine the minimum number of sensors required for adequate skin temperature monitoring of superficial hyperthermia treatments’, Int. J. Hyperthermia, vol. 34, no. 7, pp. 910–917, Nov. 2018.
