La hipertermia oncológica es un potente radio sensibilizador cuando se administra como terapia adyuvante de la radioterapia. El nuevo estudio de RaySearch Laboratories con Medlogix y Amsterdam UMC, publicado en el International Journal of Radiation Oncology, Biology, Physics, ha desarrollado un método novedosos para la optimización combinada de la planificación del tratamiento de radiosensibilización térmica y citotoxicidad térmica durecta. Hasta ahora la optimización se realizaba para cada una por separado.
La hipertermia oncológica eleva la temperatura de los tumores en el rango de 39-44 °C y se utiliza como adyuvante de la radio y/o quimioterapia para potenciar sus efectos. De hecho, se ha reportado un incremento en la supervivencia global y las probabilidades de control tumoral (TCP, por sus siglas en inglés) de alrededor de 5-20 puntos porcentuales para diversas indicaciones (vejiga1, recurrencia de mama2, cérvix1,3, cabeza y cuello, melanoma4, próstata y recto1)5,6.
Cuando se utiliza la hipertermia como terapia adyuvante de la radioterapia (termorradioterapia), se planifica cada una por separado, a pesar de la acción sinérgica de ambas. Para la cuantificación del efecto combinado se calcula la dosis equivalente de radiación en fracciones de 2 Gy (EQD2). La EQD2 refleja la potenciación del efecto terapéutico y cómo los parámetros modificados de radio sensibilización pueden incrementar la dosis de radiación7.
En general se conoce la homogeneidad de las temperaturas hipertérmicas y las variaciones de 1 °C pueden resultar en diferencias de hasta 2-3 Gy en la dosis equivalente.
Por otra parte, se conoce que a temperaturas hipertérmicas, las variaciones de 1 °C pueden provocar hasta 2-3 Gy de diferencia en la dosis equivalente. Por eso, el siguiente paso lógico era optimizar de forma conjunta el tratamiento combinado con la EQD. Esto es lo que ha llevado a cabo RaySearch Laboratories en colaboración con el Amsterdam UMC y Medlogix. En su prueba de concepto emplearon cuatro casos de cáncer de próstata cuyo CTV se definió como la glándula en su totalidad. Esta pequeña cohorte de pacientes tenía distribuciones de temperatura sustancialmente distintas. Se llevó a cabo la planificación de los cuatro casos según tres estrategias diferentes de escalado de dosis:
- RT60+HT: radioterapia convencional de 60 Gy (20 fracciones, una al día, cinco a la semana en cuatro semanas) con hipertermia semanal.
- RT68: escalado de dosis de radiación a 68 Gy sin hipertermia.
- RTHT+HT: radioterapia optimizada para una EQD2 uniforme que maximice la TCP, teniendo en cuenta la radio sensibilización térmica vóxel a vóxel y la citotoxicidad térmica directa de la hipertermia semanal, sin aumentar la dosis a tejidos sanos7.
Hipertermia profunda ALBA 4D de Medlogix para próstata
La hipertermia para tumores pélvicos se aplica normalmente con dispositivos radiativos en fase. En este estudio el equipo de hipertermia profunda utilizado es ALBA 4D de Medlogix. El sistema dispone de cuatro aplicadores de guía de ondas en fase que trabajan a 70 MHz para producir cuatro haces modulables de forma independiente. Así, puede focalizar la energía en los tumores de cualquier profundidad y localización en pelvis, abdomen y extremidades.
ALBA 4D se desarrolló en colaboración con el Amsterdam UMC y destaca por el escalado de dosis térmica con alta precisión, velocidad y temperatura en el tumor8,9. De esta forma, es el mejor sistema para proporcionar una elevada dosis térmica directamente al tumor con la máxima velocidad de manera que se acorte el intervalo entre la aplicación de hipertermia y de radioterapia.
Esquema de planificación del tratamiento de termorradioterapia
El estudio de Öden et al.7 propone un nuevo esquema de planificación del tratamiento de termorradioterapia con optimización vóxel a vóxel de EQD2. Su enfoque tiene en cuenta la radio sensibilización térmica y la citotoxicidad térmica directa. El objetivo principal consistía en combinar la hipertermia locorregional con radioterapia externa. De todas formas, su esquema se puede adaptar para cualquier técnica de radioterapia, englobando también la termobraquiterapia.
El flujo de trabajo publicado se divide en dos etapas: la planificación de hipertermia y la de la termorradioterapia7.
La primera etapa se necesita para lograr un plan de termorradioterapia óptimo. Consiste en la creación de un plan de hipertermia en la imagen TC de planificación, obteniendo una distribución 3D de temperatura. En este estudio, se utilizó Plan2Heat (P2H), desarrollado por Medlogix y Amsterdam UMC. Se trata de un sistema de planificación basado en DICOM que simula la temperatura de pacientes con tumores a varias profundidades (superficiales, semiprofundos y profundos)10.
En Öden et al. 7, P2H se usó en el cálculo de los campos electromagnéticos y para perfeccionar las configuraciones de amplitud de fase usando la optimización basada en la temperatura con el objetivo de 43 °C en el objetivo.
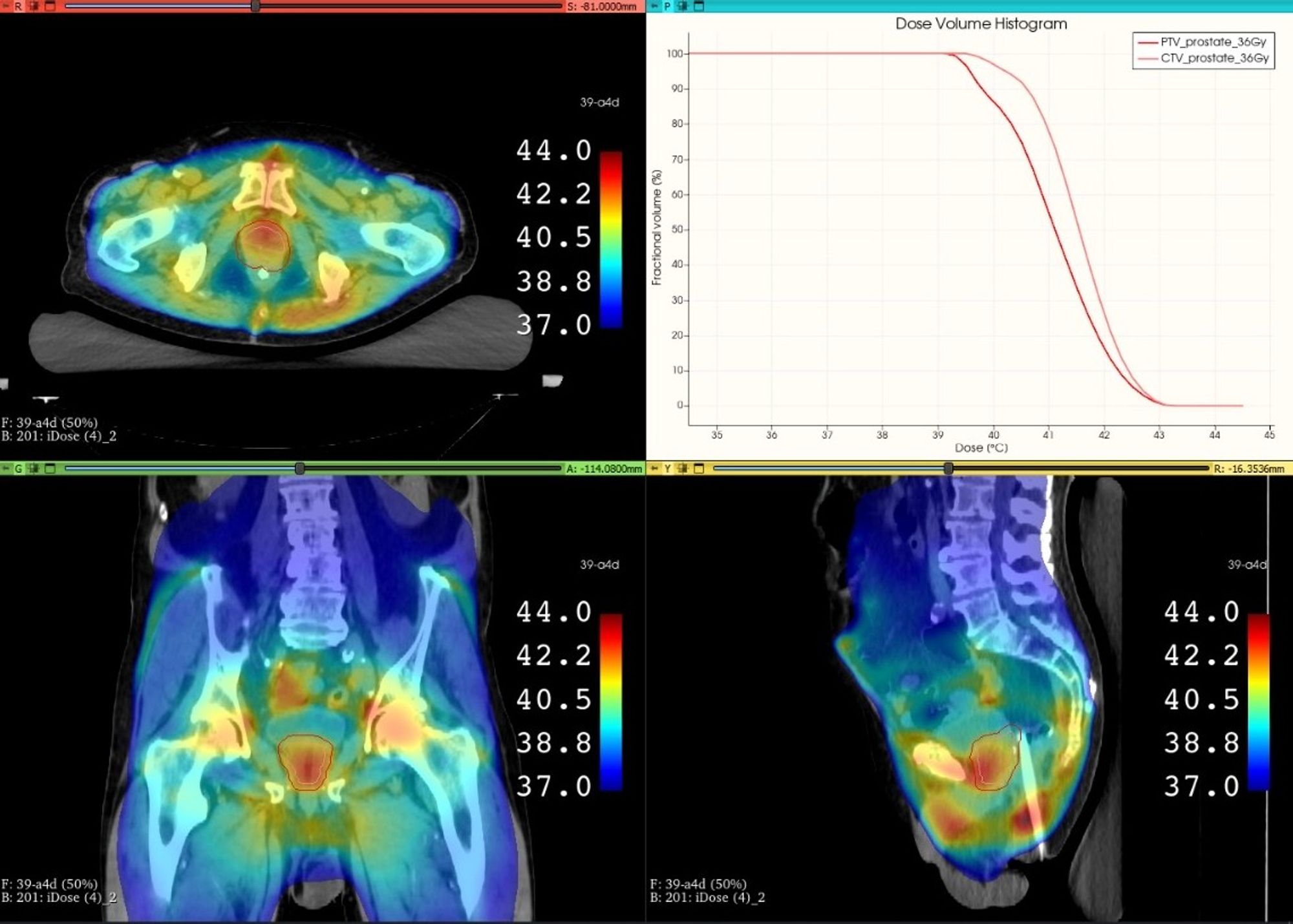
En la segunda etapa del esquema, tanto el TC de hipertermia como la distribución de temperaturas se importaron en una versión de investigación del TPS RayStation 12A7.
Las funciones de optimización de la termorradioterapia según la EQD2 penalizan cuadráticamente la EQD2 por vóxel que se desvía del nivel deseado de EQD2. Esta implementación permite combinar las funciones convencionales de perfeccionamiento de la radioterapia (que penalizan las dosis de vóxel desviadas del nivel de dosis deseado) con las funciones de optimización basadas en EQD2. La aproximación se puede aplicar para tratamientos de solo radioterapia o de termorradioterapia7.
Para modelar la radio sensibilización térmica se utiliza una versión extendida del modelo lineal-cuadrático (LQ) en el que los parámetros de radio sensibilización α y β son dependientes de la temperatura. En radioterapia este modelo LQ describe la fracción de células supervivientes tras una dosis de radiación. Los parámetros de sensibilización permiten convertir la dosis a EQD27.
Además, el efecto citotóxico térmico directo se modeló con un término separado basado en una relación de Arrhenius con reacción de primer orden11,12.
Los criterios de evaluación del estudio abarcaron la dosis, EQD2, TCP y la probabilidad de complicaciones en el tejido rectal normal (NTCP). Además, los autores realizaron un análisis de robustez para la TCP y la NTCP frente las incertidumbres de los parámetros.
Resultados del nuevo esquema de planificación optimizada de la termorradioterapia
La TCP estimada de alrededor del 76% para RT60 sin hipertermia se incrementó a una media de 85.9% en RT60+HT; 92.5% en RT68 y 94.4% en RTHT+HT. Las correspondientes NTCP rectales promediadas fueron 8.7%, 14.9% y 8.4%, respectivamente7. Estos resultados demuestran la capacidad de alcanzar una EQD2 mejorada y uniforme en el objetivo y TCP a lo largo de varias distribuciones de temperatura sin elevar la EQD2 de los tejidos normales o la NTCP con respecto a métodos convencionales.
Por tanto, se demuestra la viabilidad y potencial del esquema desarrollado en la mejora e incremento de la TCP esperada en comparación con otros enfoques convencionales de termorradioterapia. Esto se consiguió sin comprometer la cobertura del objetivo o aumentar la NTCP o dosis a los OAR. En contraste, las NTCP y dosis a OAR se redujeron comparado con un escalado convencional de dosis de radioterapia con una TCP similar a la del plan optimizado de termorradioterapia.
De esta manera, el esquema tiene el potencial de mejorar la calidad de los tratamientos de termorradioterapia y de mejorar los resultados clínicos de los pacientes oncológicos. No obstante, la extensión de la optimización depende de los datos exactos específicos del tumor y del tejido disponibles para la cuantificación precisa de los efectos hipertérmicos. En cualquier caso, dado que se trata de un esquema muy adaptable, podrán integrarse de forma eficiente en un futuro. Asimismo, se podrá ajustar de modo rápido a estrategias de planificación que buscan enfoques más efectivos y específicos del paciente.
En resumen, el estudio de Öden et al.7 introduce un enfoque innovador de planificación de la termorradioterapia, en el que se integran los efectos térmicos en la optimización de la radioterapia basada en la EQD2. Si desea más información sobre esta publicación, puede contactarnos en el siguiente enlace.
Referencias
- Van Der Zee, J., González, D. G., Van Rhoon, G. C., Van Dijk, J. D. P. & Van Putten, W. L. J. Comparison of Radiotherapy alone with Radiotherapy plus Hyperthermia in Locally Advanced Pelvic Tumors: a prospective, randomised, multicentre trial. Lancet 355, 1119–1125 (2000).
- Bakker, A. et al. Post-operative re-irradiation with hyperthermia in locoregional breast cancer recurrence: Temperature matters. Radiother. Oncol. 167, 149–157 (2022).
- Wang, Y. et al. Outcomes for Hyperthermia Combined with Concurrent Radiochemotherapy for Patients with Cervical Cancer. Int. J. Radiat. Oncol. Biol. Phys. 107, 499–511 (2020).
- Overgaard, J. et al. Randomised trial of hyperthermia as adjuvant to radiotherapy for recurrent or metastatic malignant melanoma. Lancet 345, 540–543 (1995).
- Datta, N. R. et al. Local hyperthermia combined with radiotherapy and-/or chemotherapy: Recent advances and promises for the future. Cancer Treat. Rev. 41, 742–753 (2015).
- Datta, N. R., Kok, H. P., Crezee, H., Gaipl, U. S. & Bodis, S. Integrating Loco-Regional Hyperthermia Into the Current Oncology Practice: SWOT and TOWS Analyses. Front. Oncol. 10, 819 (2020).
- Ödén, J., Eriksson, K., Pavoni, B., Crezee, H. & Kok, H. P. A novel framework for thermoradiotherapy treatment planning. Int. J. Radiat. Oncol. Biol. Phys. (2024) doi:10.1016/j.ijrobp.2024.02.012.
- Zweije, R., Kok, H. P., Bakker, A., Bel, A. & Crezee, J. Technical and Clinical Evaluation of the ALBA-4D 70MHz Loco-Regional Hyperthermia System. in 48th European Microwave Conference 328–331 (European Microwave Association, 2018). doi:10.23919/EuMC.2018.8541673.
- Kok, H. P., Navarro, F., Strigari, L., Cavagnaro, M. & Crezee, J. Locoregional hyperthermia of deep-seated tumours applied with capacitive and radiative systems: a simulation study. Int. J. Hyperthermia 34, 714–730 (2018).
- Kok, H. P. & Crezee, J. Hyperthermia Treatment Planning: Clinical Application and Ongoing Developments. IEEE Journal of Electromagnetics, RF and Microwaves in Medicine and Biology 5, 214–222 (2021).
- van Leeuwen, C. M. et al. The effect of time interval between radiotherapy and hyperthermia on planned equivalent radiation dose. Int. J. Hyperthermia 34, 901–909 (2018).
- van Leeuwen, C. M. et al. Measurement and analysis of the impact of time-interval, temperature and radiation dose on tumour cell survival and its application in thermoradiotherapy plan evaluation. Int. J. Hyperthermia 34, 30–38 (2018).